Perfilado de sección
-
-
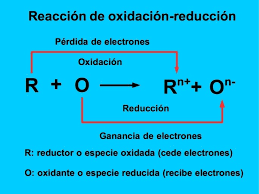
Las reacciones de óxido-reducción, también conocidas como reacciones redox, son procesos químicos en los cuales hay una transferencia de electrones entre dos especies. Estas reacciones son fundamentales en muchos fenómenos naturales y aplicaciones tecnológicas.
Conceptos Básicos
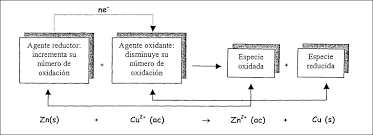
Oxidación:Proceso en el cual una sustancia o especie química pierde electrones. Aumenta el número de oxidación de la sustancia.
Reducción:Proceso en el cual una sustancia o especie química gana electrones. Disminuye el número de oxidación de la sustancia.
Agente oxidante: Sustancia que causa la oxidación de otra sustancia (gana electrones).Agente reductor: Sustancia que causa la reducción de otra sustancia (pierde electrones).
-
Aplicaciones de las reacciones Redox
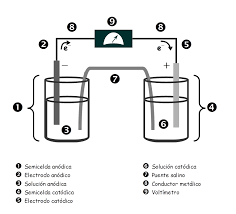
Baterías: Las reacciones redox son fundamentales en el funcionamiento de baterías, donde la energía química se convierte en energía eléctrica.
Corrosión:La oxidación de metales, como el hierro, produce óxido (ej. óxido de hierro), lo que es un problema en la industria y la construcción.
Fotosíntesis: Proceso biológico en el que las plantas convierten la energía solar en energía química mediante reacciones redox.
Respiración Celular:Los organismos obtienen energía de la oxidación de nutrientes, liberando energía en forma de ATP.
Tratamientos de Agua: Procesos de oxidación se utilizan para eliminar contaminantes y desinfectar el agua.
-
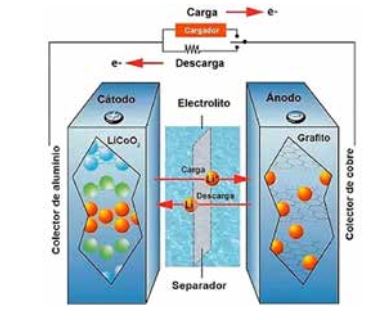
Reacciones Redox en una Pila de Litio
Las pilas de litio son esenciales en dispositivos electrónicos y vehículos eléctricos, y su funcionamiento se basa en reacciones de óxido-reducción (redox). Aquí te presento un resumen de sus componentes y las reacciones que ocurren.Componentes de la Pila de Litio
Ánodo: Compuesto principalmente de grafito. Durante la descarga, el litio se intercalará en la estructura del grafito, lo que permite el almacenamiento de energía. Aquí se produce la perdida de electrones ( reacciones de oxidación).
Cátodo: Generalmente formado por materiales como óxido de cobalto de litio (LiCoO₂) o fosfato de hierro y litio (LiFePO₄). Aquí es donde ocurre la reducción de los iones de litio. Aquí las especies químicas o sustancias aceptan electrones ( reacciones de reducción)
Electrolito: Una solución de sal de litio disuelta en un solvente orgánico, que permite la movilidad de los iones de litio entre el ánodo y el cátodo.
Separador:Un material que impide el contacto físico entre el ánodo y el cátodo, evitando cortocircuitos, pero permite el paso de iones de litio.
Proceso de Carga y Descarga
Durante la descarga: Los iones fluyen a través del electrolito desde el ánodo hacia el cátodo de oxido de cobalto-litio , generando corriente eléctrica.
Durante la carga: Se aplica una corriente externa que invierte las reacciones, depositando litio de nuevo en el ánodo.
-
