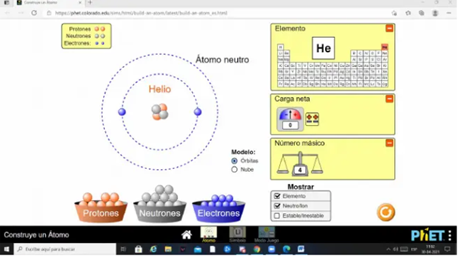
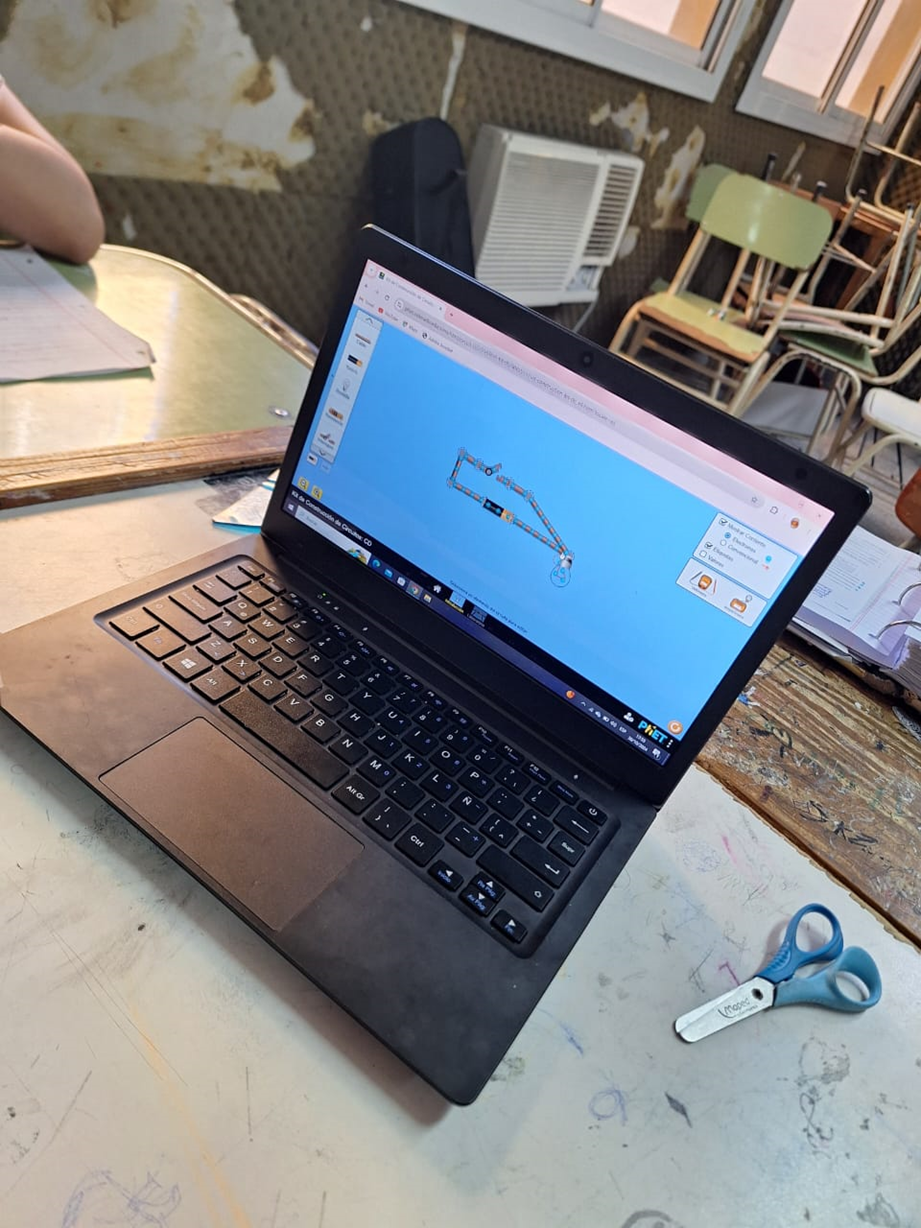
Buenas noches, comparto con ustedes una experiencia de clase que se realizó en el primer año del Profesorado de educación secundaria en Física, en la que se utilizó como recurso de apoyo para la clase el simulador https://phet.colorado.edu/sims/html/states-of-matter-basics/latest/states-of-matter-basics_all.html, en la cual se trabajaron los contenidos: Ley de Boyle-Mariotte. Ley de Charles-Gay Lussac. Ley de los gases ideales. Ecuaciones.
Les comparto la propuesta:
OBJETIVO GENERAL:
Que el alumno logre:
Comprender y aplicar las leyes de Boyle-Mariotte, Charles-Gay Lussac y los gases ideales en situaciones prácticas, desarrollando habilidades experimentales y de resolución de problemas.
OBJETIVO ESPECIFICO:
El alumno será capaz de:
- Identificar la relación entre presión y volumen en la Ley de Boyle-Mariotte.
- Relacionar volumen y temperatura en la Ley de Charles-Gay Lussac.
- Utilizar la ecuación de los gases ideales para resolver problemas.
- Aplicar los conceptos y métodos de resolución de ecuaciones, desarrollando habilidades matemáticas y de razonamiento lógico.
ACTIVIDADES DE INICIO:
Se inicia la clase utilizando el simulador de PHET colorado https://phet.colorado.edu/sims/html/gas-properties/latest/gas-properties_all.html?locale=es
Los alumnos deberán observar lo que sucede y responder a las preguntas:
¿Qué variables observan? ¿Qué se puede modificar? Si el volumen es constante, ¿Qué se puede cambiar? ¿Cómo se comporta la temperatura y la presión? Si la temperatura es constante, ¿Cómo se comporta el volumen y la presión?
ACTIVIDADES DE DESARROLLO:
El comportamiento de los gases frente a variaciones de presión y temperatura fue objeto de estudio de diversos científicos desde el siglo XVII. Así surgieron las leyes de los gases. La justificación de estas leyes mediante el modelo cinético-molecular contribuyó al conocimiento de la estructura corpuscular de la materia.
Ley de Boyle-Mariotte: En el siglo XVII, Robert Boyle (1627-1691) en Inglaterra, y Edme Mariotte (1620-1684) en Francia, estudiaron las variaciones que experimentaba la presión de un gas, manteniendo la temperatura constante y modificando el volumen del recipiente que lo contenía.
|
La teoría cinética justifica la ley de Boyle-Mariotte:
· Al mantenerse constante la temperatura, la velocidad media de las partículas del gas se mantiene constante y los choques tienen la misma energía.
· Como las partículas se mueven a la misma velocidad y tienen la misma energía, al reducir el volumen aumenta la presión. Es decir, hay mayor número de choques, ya que las partículas deben recorrer una menor distancia para colisionar con las paredes del recipiente.
|
En cambio, al aumentar el volumen, tardarán más en chocar con las paredes del recipiente y, por tanto, se producirán menos colisiones. Ello hará que la presión disminuya.
|
Ley de Boyle-Mariotte
Para una determinada masa de gas, a temperatura constante, el producto de la presión que se ejerce sobre una cantidad de gas por el volumen que este ocupa es constante.
P1 x V1 = P2 x V2 = constante
|
Se explica con un ejemplo.

Luego, los alumnos deberán realizar la siguiente actividad:
Una masa gaseosa ocupa un volumen de 500 L a 5atm de presión y 20°C a temperatura: ¿Cuál será su volumen a la presión de 2,4 atm, si se mantiene constante la temperatura?

Luego se explica la Ley de Charles y de Gay-Lussac
El químico francés Joseph-Louis Gay-Lussac es conocido principalmente por los estudios que llevó a cabo a comienzos del siglo XIX sobre el comportamiento de los gases. Aproximadamente en la misma época, el científico, también francés, Jacques Alexandre Charles, analizó las variaciones que experimentaba el volumen de una determinada masa de gas al mantener constante la presión y variar la temperatura. Los resultados obtenidos por Charles fueron confirmados posteriormente por Gay-Lussac. De este modo, los estudios experimentales de dichos científicos concluyeron en la formulación de la ley de Charles y Gay-Lussac:

|
La teoría cinética explica la ley de Charles y Gay-Lussac:
• Si aumenta la velocidad a la que se mueven las partículas de un gas, también aumenta la temperatura.
• Al aumentar la temperatura aumenta el número de choques de las partículas del gas y, al aumentar el volumen, se producen menos choques por unidad de tiempo. Si ambos efectos se compensan, la presión se mantendrá constante.
|
Inmediatamente se realiza con los alumnos el siguiente ejemplo

Seguidamente realiza la siguiente actividad:

Para ir cerrando con la clase, se explicará la Ley general de los gases.
Unificamos la ley de Boyle-Mariotte con la ley de Charles Gay-Lussac y obtenemos una ley completa de los gases.
Ecuación del gas ideal
No siempre los gases que intervienen en las reacciones se encuentran a la presión de 105 Pa y a 273 K de temperatura.
Los gases, independientemente de su naturaleza, presentan un comportamiento similar ante los cambios de presión y temperatura. Podemos considerar que cumplen las siguientes leyes: ley de Boyle-Mariotte, ley de Charles y Gay-Lussac y ley completa de los gases.

Existe una expresión que relaciona el número de moles y el volumen del gas en condiciones dadas de presión y temperatura, y recibe el nombre de ley de los gases ideales:
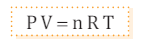
En esta ecuación, R es la constante universal de los gases y su valor en el sistema internacional es 8,31 Pa × m3 × K-1 × mol -1 = 8,31 J × K-1 × mol-1 .

Ejemplo
|
Determinemos la presión que ejercería el hidrógeno en una reacción cuyas condiciones sean de 288 K, en un volumen de 2L. También conocemos que la cantidad a usar de H2 5 moles.
|
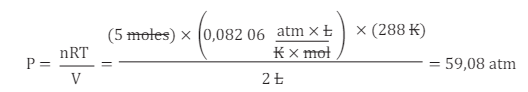
ACTIVIDADES DE CIERRE Y EVALUACIÓN
Para el cierre de la clase los alumnos deberán realizar las siguientes actividades:
Resolver
1-Un gas ocupa 0,4 m3 a 305 K y 1,82 × 106 Pa. Calcula a qué presión estará sometido si doblamos el volumen y mantenemos la temperatura constante.
2- Un recipiente contiene 0,2 m3 de cierto gas a una presión de 100 atm. ¿Qué volumen ocuparía el gas si estuviera a la presión normal y a la misma temperatura?
Datos: V1 = 0,2 m3; P1 = 100 atm; P2 = 1 atm
Apliquemos la ley de Boyle-Mariotte
3-Un gas a 30 °C ocupa 3,25 litros. Si la presión se mantiene constante, ¿cuál será el volumen del gas si lo enfriamos hasta 2 °C?
Datos: V1 = 3,25 L; T1 = (30 + 273)K = 303K; T2 = (2 + 273)K = 275 K
Fundamentación:
La incorporación del simulador PhET en la enseñanza de las leyes de los gases tiene un gran valor pedagógico y práctico. Algunos fundamentos de su uso: Visualización de Conceptos Abstractos: Las leyes de Boyle-Mariotte y de Charles-Gay Lussac, así como la ecuación de los gases ideales, describen relaciones entre variables físicas que no siempre resultan intuitivas para los estudiantes. El simulador permite visualizar cómo cambia la presión, volumen o temperatura en tiempo real. Esto facilita una comprensión más profunda del comportamiento de los gases, al representar dinámicamente lo que ocurre a nivel de partículas. Experimentación sin laboratorio: PhET simula experimentos virtuales que de otra forma serían difíciles o peligrosos de realizar en un laboratorio. Esto permite que los estudiantes registren datos de presión y volumen en distintos escenarios y analicen la relación entre variables, sin los riesgos asociados a gases presurizados o temperaturas extremas. Participación activa del alumno: A través de la manipulación de variables en el simulador, los estudiantes pueden explorar las relaciones entre presión, volumen y temperatura por sí mismos. Al responder preguntas sobre cómo se comportan estas variables, los estudiantes construyen activamente su comprensión, en lugar de limitarse a memorizar conceptos teóricos. En resumen, el uso del simulador PhET en esta clase no solo facilitó la comprensión de las leyes de los gases, sino que también permitió a los estudiantes desarrollar habilidades de análisis, experimentación, trabajo en equipo y resolución de problemas en un entorno controlado, seguro y visualmente estimulante. Esto, a su vez, reforzó actitudes positivas hacia el aprendizaje de la ciencia y las matemáticas, promoviendo una comprensión más integrada y práctica de los contenidos.
Considero que hubiera sido interesante que hubiera incluido alguna actividad en el aula virtual donde a través de un foro los alumnos puedan compartir sus análisis y dudas, para que se puedan ir ayudando y colaborando entre ellos también.
Me gustó mucho el curso, aún no ejerzo en el nivel secundario, pero considero que el uso del aula virtual y las herramientas que se encuentran en Educaplay son excelentes y muy atractivas para los estudiantes, me gustó mucho el curso y espero que pronto podamos acceder a más cursos interesantes como este. Muchas gracias!

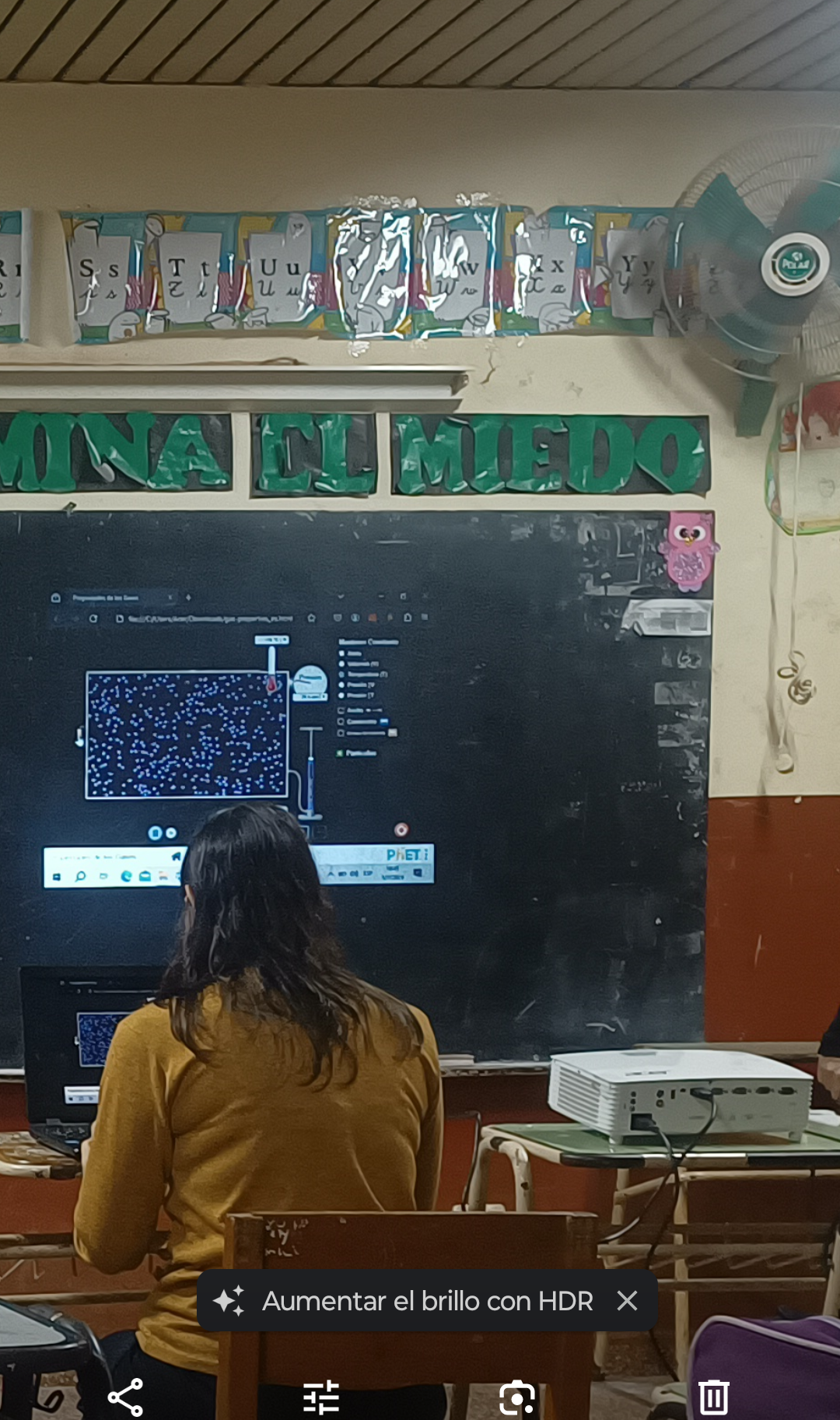













 A partir de la elección del simulador PhET como recurso propuesto del aula virtual “Química en reacción: Formulá tu aula virtual”, en conjunto con el recurso audiovisual ...
A partir de la elección del simulador PhET como recurso propuesto del aula virtual “Química en reacción: Formulá tu aula virtual”, en conjunto con el recurso audiovisual ...
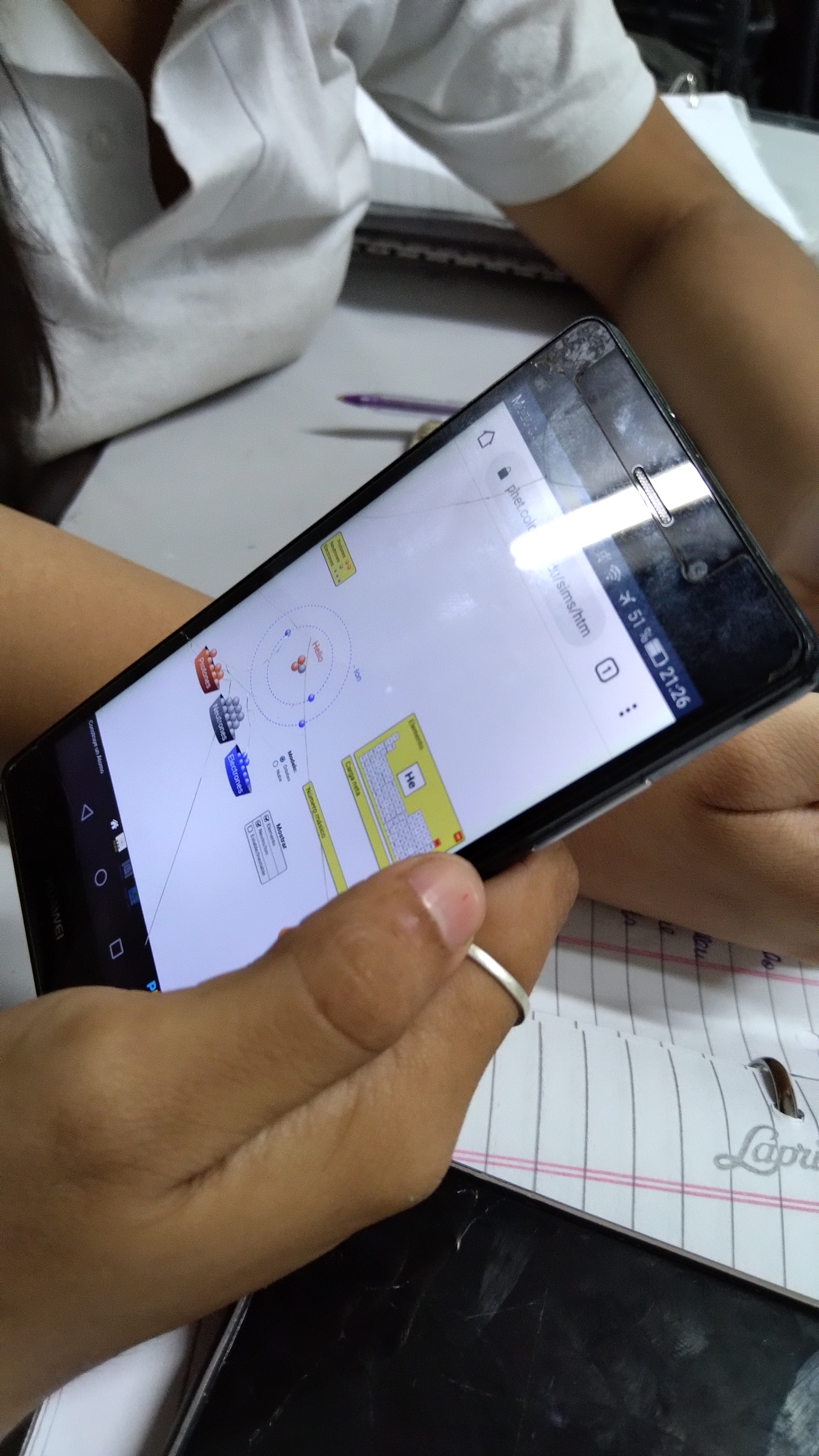

 Buenas noches. Comparto a continuación, mi fundamentación, con el registro fotográfico y adjunto la secuencia desarrollada
Buenas noches. Comparto a continuación, mi fundamentación, con el registro fotográfico y adjunto la secuencia desarrollada





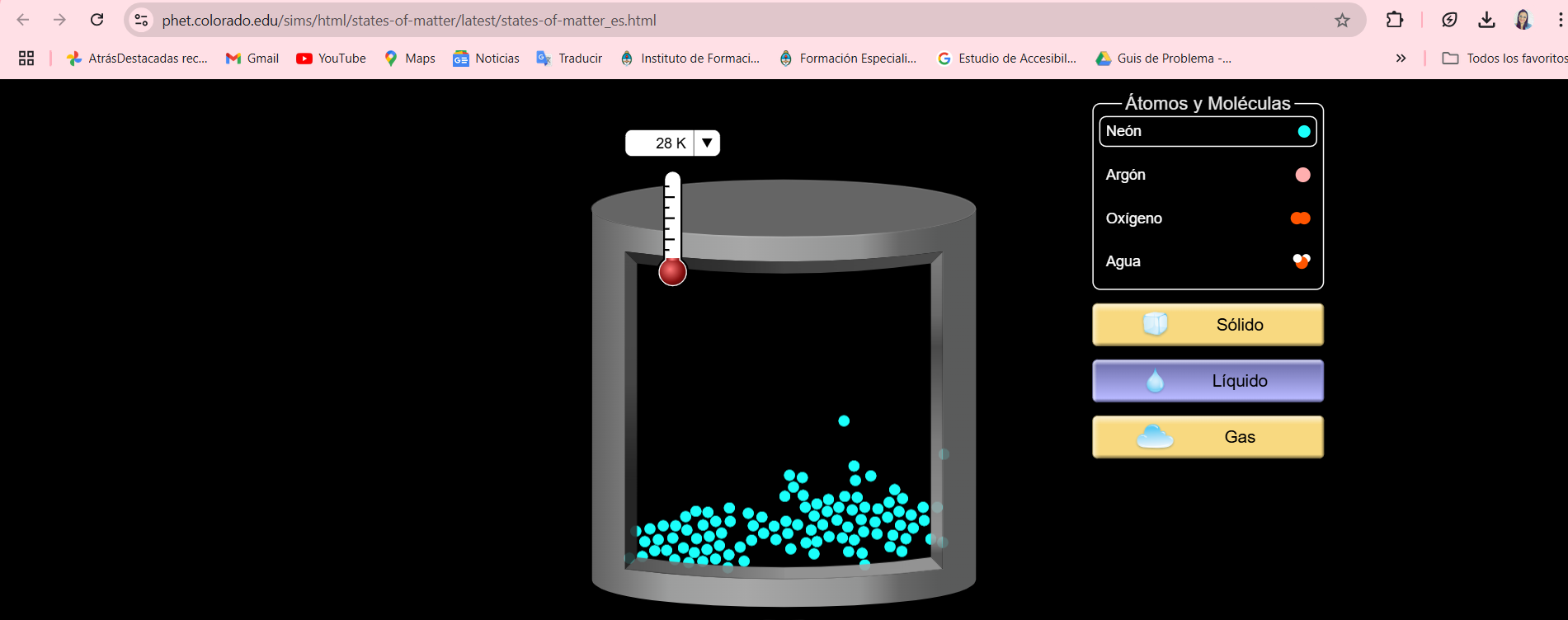






 Estudiante: Linndeman, Mariela Soledad
Estudiante: Linndeman, Mariela Soledad






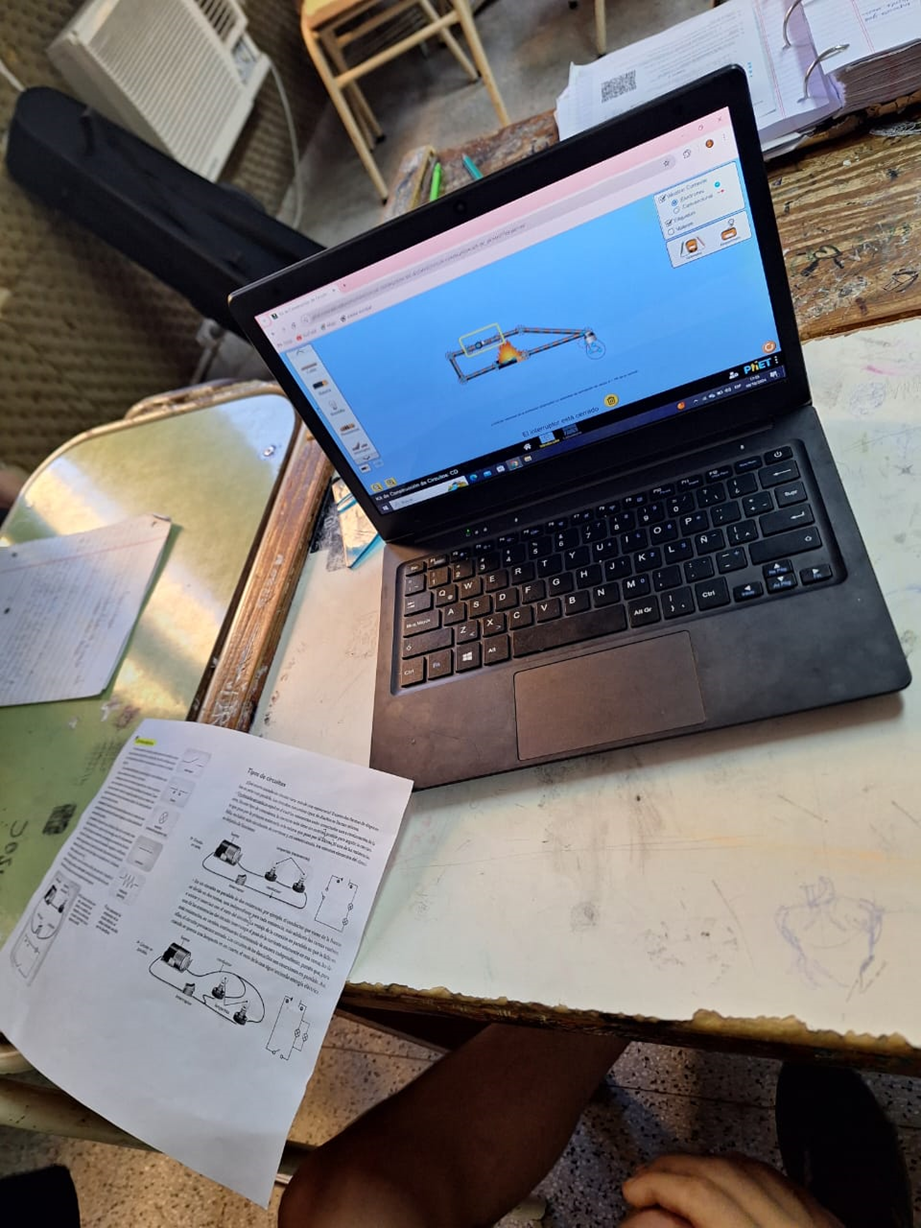





















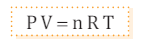

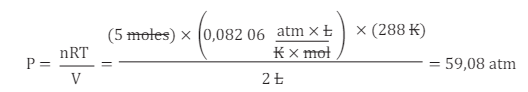


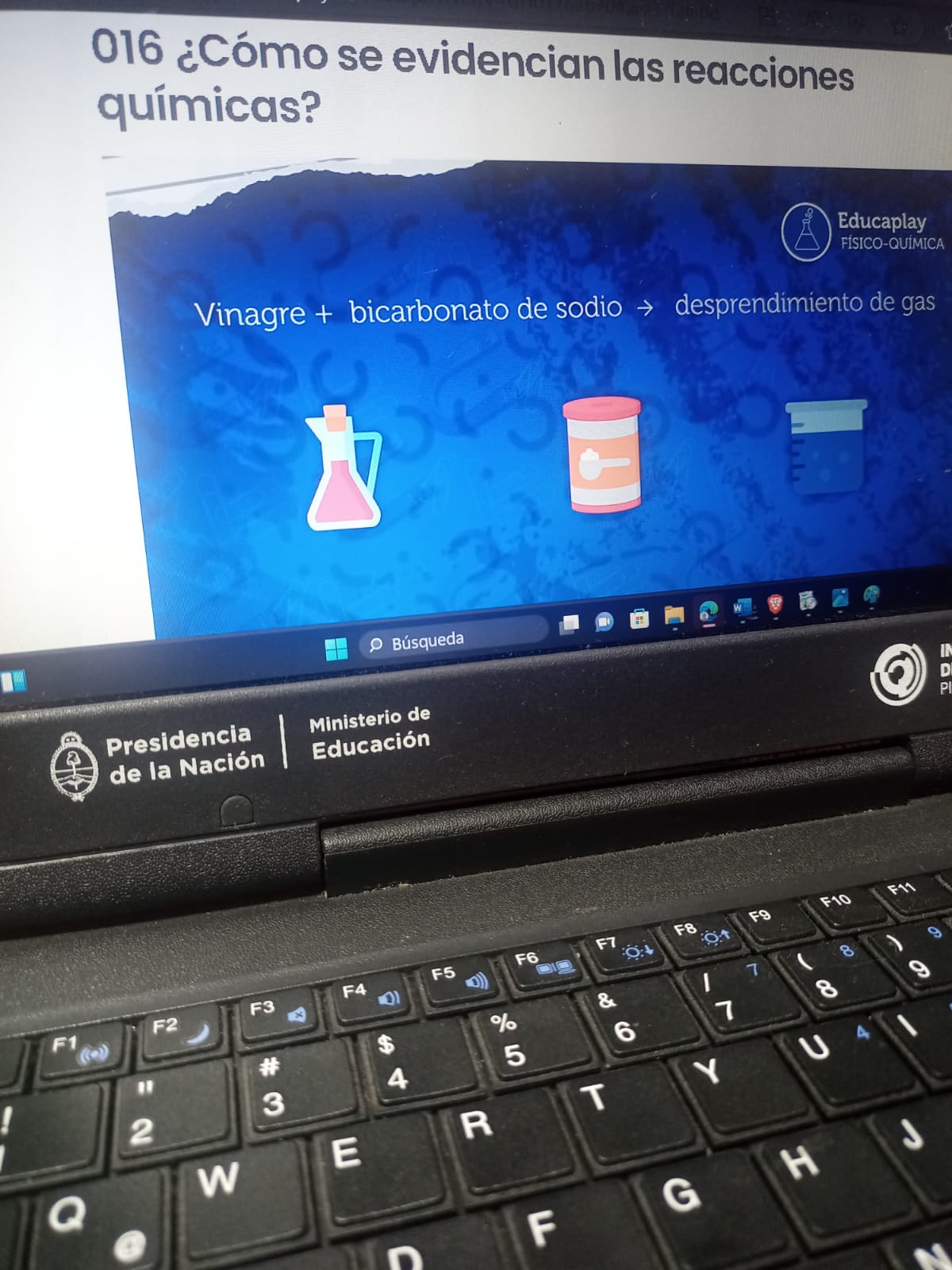

 CURSO: QUÍMICA EN ACCIÓN. FORMULÁ TU AULA VIRTUAL
CURSO: QUÍMICA EN ACCIÓN. FORMULÁ TU AULA VIRTUAL
 Buenos días!
Buenos días!